ベンザイン

ベンザイン (benzyne) とは、分子式 C6H4 で表される、ベンゼンから水素原子を2つ取り除いたジデヒドロベンゼンのことである。取り除く2つの水素の位置によって3種の構造異性体、すなわち o-ベンザイン(1,2-ジデヒドロベンゼン)、m-ベンザイン(1,3-ジデヒドロベンゼン)、p-ベンザイン(1,4-ジデヒドロベンゼン)が存在する。いずれも極めて不安定な化合物であり、反応中間体としてのみ知られている。
置換基を持つベンザイン誘導体やジデヒドロピリジン(ピリダイン)など、他芳香環上の水素原子を取り除いた類縁体を含めてアラインと総称される。
o-ベンザイン[編集]
結合[編集]
ベンザインのアルキンとしての描写は最もよく目にするものであるが、クムレンおよびジラジカル構造が重要な共鳴寄与体である[1]。
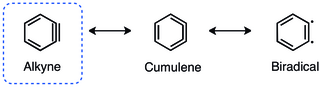
ortho-ベンザイン中の三重結合の幾何学的制約によって面内のp軌道の重なり合いが減少し、三重結合は弱くなる[2]。ベンザイン中の三重結合の振動周波数はRasziszhewskiによって1846 cm−1にアサインされた[3]。これは、ベンザイン中の三重結合が約2150 cm−1の振動周波数を持つひずみのないアルキン中の三重結合よりもかなり弱いことを示している。にもかかわらず、張りつめたアルキンはビラジカルよりもo-ベンザインの三重結合の性質をよく描写している(より大きな一重項-三重項ギャップとアルキン様の反応性)[4]。幾何的制約は、アライン類のLUMOのエネルギーの顕著な低下ももたらすが(2-ブチンで6.41 eV、ベンザインで1.33 eV)、計算によればHOMOのエネルギーは本質的に変化しない[5]。

アライン類のLUMO軌道のエネルギーはひずみのないアルキンのLUMOよりもかなり低く、これによって求核剤のHOMOとよりエネルギーが一致する。したがって、ベンザインは求電子的性質を有し、求核剤と反応する[6]。ベンザインの詳細なMO解析は1968年に提示された[7]。

存在の提唱[編集]
o-ベンザインの存在はワーナー・バックマンらによって1927年に初めて提唱された。ゲオルク・ウィッティヒは1940年にフルオロベンゼンとフェニルリチウムを反応させた際に2-リチオビフェニルが生成してくることを見出した。ウィッティヒらは1942年にこの反応の機構としてフルオロベンゼンのオルト位がリチオ化された後フッ化リチウムが脱離してo-ベンザインが生成し、これにフェニルリチウムが付加して2-リチオビフェニルとなるという機構を提唱した。また1953年にはJ.D.ロバーツらによってクロロベンゼンと液体アンモニア中のナトリウムアミドからアニリンが生成する芳香族求核置換反応で、塩素原子の結合している炭素原子を14Cで同位体標識しておくと、生成物のアニリンのアミノ基の結合している炭素とそのo-位の炭素が50%ずつ同位体標識されるという結果が報告された。

この結果は、クロロベンゼンから塩化水素の脱離により生成した対称なo-ベンザインにアンモニアが付加したと考えるとうまく説明できる。また1956年にはウィッティヒらによって1-ブロモ-2-フルオロベンゼンをフラン中でリチオ化すると、o-ベンザインとフランがディールス・アルダー反応したと考えられる生成物が得られてくることが報告された。 これらの研究によってo-ベンザインが実在していることはほぼ間違いないものと考えられるようになった。
スペクトルによる確認[編集]
1962年から1964年にかけて1,2-ジヨードベンゼンやo-ベンゼンジアゾニウムカルボキシラートの熱分解によって生成させた気相中のo-ベンザインのマススペクトルや紫外吸収スペクトルが測定された。1973年から1975年にかけてO.L.チャップマンらにより過酸化フタロイルを光分解することによって生成したo-ベンザインの赤外吸収スペクトルがマトリックス単離法で測定された。o-ベンザインの極限構造式としては三重結合を持つもの、ジラジカル構造を持つもの、集積二重結合構造を持つものが考えられる。チャップマンらは赤外吸収スペクトルの三重結合の吸収領域に近い2085cm-1に吸収が見られたことから、ベンザインの構造は三重結合に近いと提唱された。しかしこの吸収が本当にベンザインの三重結合によるものなのかについて長い間議論が続いた。最終的にはこの論争は1992年に行なわれた同位体置換したベンザインの赤外吸収スペクトルの測定により、三重結合による吸収が1846 cm-1にあることが帰属されて決着がついた。1986年にはマイクロ波吸収スペクトルの報告がされた。1996年にはマトリックス単離法で固体核磁気共鳴スペクトルの測定も成功している。
構造[編集]

各種スペクトルデータから判明している構造は以下の通りである。
o-ベンザインはベンゼンと同様に平面状の分子である。o-ベンザインの構造は、C3-C6軸方向にわずかに伸びた六角形の構造となっている。C1-C2の間は1.24Åと典型的な二重結合(エチレン:1.34Å)と典型的な三重結合(アセチレン:1.20Å)の中間の値となっている。他の結合距離はC2-C3が1.41Å、C3-C4が1.38Å、C4-C5が1.43Åとなっている(σ対称性のためC5-C6はC3-C4と、C6-C1はC2-C3と等しい)。また炭素と水素との結合距離は1.08Åである。結合角はC1-C2-C3が126°、C2-C3-C4が111°、C3-C4-C5が123°、C2-C3-Hが123°、C4-C5-Hが118°となっている。
調製[編集]
すでに挙げたような方法によって調製できるが、方法としては主に2つに大別される。
一つは脱離基となる置換基のオルト位にカルバニオンを発生させる方法であり、もっとも一般的に利用されている。温和な条件でo-ベンザインを発生できる前駆体としてはo-トリメチルシリルフェニルトリフラートやフェニル(o-トリメチルシリルフェニル)ヨードニウムトリフラートなどが知られている。これらはテトラブチルアンモニウムフルオリド (TBAF) で処理すると、トリメチルシリル基が脱離してカルバニオンを発生し、o-ベンザインが生成する。
もう一つは光や熱分解により2つの置換基を脱離させる方法で、アントラニル酸のジアゾ化により生成するベンゼンジアゾニウムカルボキシラートや過酸化フタロイルが利用される。ベンゼンジアゾニウムカルボキシラートは窒素と二酸化炭素を放出して、過酸化フタロイルは二分子の二酸化炭素を放出してo-ベンザインを生成する。
反応性[編集]
o-ベンザインの三重結合は安定な形である直線型から大きく歪んでいるため高い反応性を示す。気相中ではすぐに二量化してジベンゾシクロブタジエンとなる。また溶液中では三重結合は求電子試薬として振舞い、多くの求核試薬の付加反応を受ける。またディールス・アルダー反応の強力なジエノフィルとして振舞い、フランやアントラセンといった比較的ジエンとしては反応性の乏しい化合物とも付加体を作る。
m-ベンザイン[編集]
m-ベンザインの存在は1963年から1965年にかけて行なわれた1,3-ジヨードベンゼンやm-ベンゼンジアゾニウムカルボキシラートの熱分解生成物の研究で提案された。
スペクトルによる確認がはじめてなされたのは1992年で、3-ジアゾ-6-オキソシクロヘキサ-1,4-ジエン-1-カルボン酸を光分解して生成した2,4-ジデヒドロフェノールをマトリックス単離法で単離して赤外吸収スペクトルで確認している。無置換のm-ベンザインは1996年にイソフタル酸と酢酸の混合過酸化物の熱分解物を10Kのアルゴン中にトラップして、赤外吸収スペクトルにより確認された。
m-ベンザインは開環して1,5-ヘキサジイン-3-エンへと異性化する。これはp-ベンザインにも見られる反応であるが、異性化がp-ベンザインを経ているかどうかは議論の対象となっている。
p-ベンザイン[編集]
p-ベンザインもm-ベンザイン同様、1,4-ジヨードベンゼンやp-ベンゼンジアゾニウムカルボキシラートの熱分解の研究がまず行なわれた。しかし、これらの研究ではp-ベンザインの存在を示すようなデータは得られなかった。これはp-ベンザインが開環して1,5-ヘキサジイン-3-エンへと異性化しやすいためである。
p-ベンザインは1971年に正宗・バーグマン環化の反応中間体として提唱された。1,5-ヘキサジイン-3-エン構造を持つ化合物を加熱すると、環化しながら還元が起こりベンゼン環が生成する。重水素化された溶媒中でこの反応を行なうと1,4-位に重水素化されたベンゼン環が生成する。これは反応中間体としてp-ベンザインが生成し、これが溶媒からの水素引き抜き反応を起こしてベンゼン環となったとすると説明できる。
スペクトルによる確認がはじめてなされたのは1976年にL.O.チャップマンらによってで、アントラキノンビスケテンを光分解して生成した9,10-ジデヒドロアントラセンをマトリックス単離法で確認している。無置換のp-ベンザインは1998年に10 Kのアルゴン中でテレフタル酸と酢酸の混合過酸化物の光分解で生成されたものが、赤外吸収スペクトルにより確認された。
p-ベンザインは溶媒などから水素を引き抜いてベンゼンになりやすい。カリケアミシンのような環状エンジイン構造を持つ物質は生体内で正宗・バーグマン環化を起こしてp-ベンザインを生成し、DNAから水素引き抜き反応を起こしてDNAを切断する。このメカニズムを利用して、白血病の治療薬としての利用が行なわれている。また、加熱下や光照射下では正宗・バーグマン環化の逆反応が進行し、開環して1,5-ヘキサジイン-3-エンとの平衡状態になる。
脚注[編集]
- ^ Anslyn, E. V.; Dougherty, D. A. (2006). Modern Physical Organic Chemistry. University Science Books. pp. 612. ISBN 978-1-891389-31-3
- ^ Gampe, C. M.; Carreira, E. M. (2012). “Arynes and cyclohexyne in natural product synthesis”. Angew. Chem. Int. Ed. 51: 3766-3778. doi:10.1002/anie.201107485. PMID 22422638.
- ^ Radziszewski, J. G.; Hess, B. A., Jr.; Zahradnik, R. (1992). “Infrared spectrum of o-benzyne: Experiment and theory”. J. Am. Chem. Soc. 114 (1): 52–57. doi:10.1021/ja00027a007.
- ^ Wenk, H. H.; Winkler, M.; Sander, W. (2003). “One century of aryne chemistry”. Angew. Chem. Int. Ed. 42: 502-528. doi:10.1002/anie.200390151. PMID 12569480.
- ^ Rondan, N. G.; Domelsmith, L. N.; Houk, K. N. (1979). “The relative rates of electron-rich and electron-deficient alkene cycloadditions to benzyne. Enhanced electrophilicity as a consequence of alkyne bending distortions”. Tetrahedron Lett. 20: 3233-3240. doi:10.1016/S0040-4039(01)95372-9.
- ^ Gilchrist, T. L. (1983). “Chapter 11: Arynes”. In Patai, S.; Rappaport, Z.. Triple-Bonded Functional Groups: Volume 1. PATAI'S Chemistry of Functional Groups. New York: John Wiley & Sons. doi:10.1002/9780470771693. ISBN 9780470771693.
- ^ Hoffmann, R.; Imamura, A.; Hehre, W. J. (1968). “Benzynes, dehydroconjugated molecules, and the interaction of orbitals separated by a number of intervening sigma bonds”. J. Am. Chem. Soc. 90: 1499-1509. doi:10.1021/ja01008a018.
関連文献[編集]
- 大石健「ベンザイン化学の新展開」『有機合成化学協会誌』第66巻第1号、有機合成化学協会、2008年、74-75頁、doi:10.5059/yukigoseikyokaishi.66.74。
